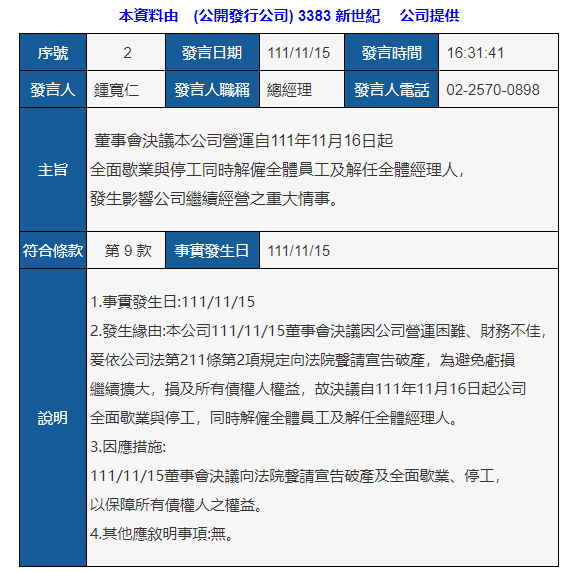
胃癌治疗的最新研究进展
前言
胃癌是一个全球性的健康挑战。2020年胃癌新增病例1089103例,死亡768793例,是全球第五大常见癌症和第四大癌症死亡原因。胃癌的流行病学分布因性别和地理区域而异,男性的发病率是女性的两倍,东亚和东欧的发病率更高。胃癌通常可以根据两个解剖亚型分类,此外也包括不同的组织学和分子亚型。
晚期胃癌和胃食管交接部癌(GOJC)患者的预后较差,5年相对生存率为6%。尽管化疗和手术方案有所改善,但这些患者的预后仍然很差。在晚期胃癌中,只有曲妥珠单抗和一些免疫检查点抑制剂,如nivolumab和pembrolizumab以及化疗,分别在HER2阳性和PD-L1阳性肿瘤患者中显示出一致和可靠的疗效。目前,针对胃癌和胃食管癌的内在特征,多种药物正在进行II期和III期临床试验,这些试验涉及靶向药物或免疫疗法,部分已经显示出良好的应用前景,有望改善胃癌患者的预后和生存。
胃癌的分子特征
约40%的胃癌在编码受体酪氨酸激酶蛋白(RTK)的基因中有扩增,如EGFR、ERBB2(HER2)、ERBB3、FGFR2、JAK2和MET、KRAS或NRAS、细胞周期介质和VEGFA。开发中的大多数胃癌II期和III期临床试验都是针对这些分子异常的治疗药物。
2014年,癌症基因组图谱(TCGA)计划确定了四种胃癌亚型:EBV、微卫星不稳定型(MSI)、染色体不稳定型(CIN)和基因组稳定型。

分子亚型与预后相关,MSI和EBV亚型切除胃癌肿瘤的患者术后进展似乎比其他肿瘤亚型患者好,基因组稳定的胃癌患者无复发生存率最差,CIN亚型患者从辅助化疗中获益最多。在转移性环境中, MSI-H的肿瘤患者对免疫检查点抑制剂(ICI)的治疗有最大反应。
这些分子特征显示了患者间的异质性,这是一系列II期和III期临床试验失败的主要原因。此外,高达36%的胃癌表现出空间内异质性,原发性和转移性病变之间存在不一致。当比较靶向治疗前后同一患者的肿瘤样本时,还显示出时间异质性。通常与耐药机制有关。
抗HER2治疗
在一线治疗中,抗HER2抗体trastuzumab在2010年的III期TOGA试验中,在HER2阳性肿瘤患者中显示出益处。实验组患者的中位总生存率有所提高,尤其是免疫组化(IHC)评分为3+或FISH阳性且IHC评分为2+的患者。然而,随后在胃癌和HER2阳性肿瘤患者中进行的不同II期和III期试验的结果令人失望。JACOB试验将化疗加trastuzumab和化疗加trastuzumab以及pertuzumab进行了比较,最终分析未显示总生存率有显著改善(HR 0.84,95%CI 0.71–1.00;P?=?0.057)。
Lapatinib是EGFR和HER2的小分子酪氨酸激酶双抑制剂,在HER2扩增肿瘤患者的一线(LOGIC试验)和二线(TyTAN试验)治疗中均未显示出疗效。而T-DM1也在HER2扩增肿瘤患者的二线治疗中失败了(GATSBY试验)。
HER2靶向治疗也已在局部晚期可切除胃癌中得到评估。II期NEOHX试验是首次公开的研究,显示了HER2阻断剂的活性。该II期非随机试验在36例HER2阳性胃癌患者中测试了奥沙利铂和卡培他滨与trastuzumab的联合治疗。达到了主要终点,18个月无病生存率为71%(95%CI 53-83%)。此外,提前结束的随机二期PETRARCA试验评估了trastuzumab和pertuzumab联合标准FLOT联合化疗与单独化疗的疗效。双HER2阻断联合FLOT化疗显著提高了病理完全缓解率(12%对35%;P=0.02)和阴性淋巴结的百分比(39%对68%)。
部分临床试验的失败,除了归咎于HER2评分的复杂性之外,还包括HER2靶向治疗的耐药机制。一些基因改变可以补偿HER2信号传导阻断,如PTEN的缺失、PIK3CA、FGFR2融合的激活突变以及CCNE1或EGFR的扩增。此外,抗HER2治疗后可产生获得性耐药,HER2表达的缺失是更常见的耐药机制之一;EGFR和MET扩增可以激活PI3K信号,克服路径上游的HER2抑制。
为了克服这些挑战,正在开发新型ADC和更有效抗体的新策略。Trastuzumab–deruxtecan是一种新型的ADC,由Trastuzumab、可裂解的四肽连接子和拓扑异构酶I抑制剂有效载荷组成。这种药物具有旁观者效应,能够破坏周围的细胞,考虑到肿瘤的异质性,这种效应是一个很有趣的机制。DESTINY-Gastric01试验是一项针对两种或多种治疗方案的随机II期试验,总体有效率(ORR)的主要目标已实现,两组之间存在显著差异:接受Trastuzumab–deruxtecan治疗的为51%,而对照组(紫杉醇或伊立替康)为14%(P<0.001)。其他HER2靶向ADC目前正在进行临床试验,用于HER2阳性胃癌患者。
Margetuximab是一种具有高亲和力的抗HER2抗体,在一期试验中作为单一药物显示出良好的活性,总体控制率为62%,50%的患者病情稳定,12%的患者有部分缓解。Tucatinib是一种小分子药物,可逆地结合HER2受体内部结构域的ATP结合袋,目前正在进行的一项II–III期试验。最后,zanidatamab,一种阻断HER2胞外结构域2和4的双特异性抗体,目前正在研究中。
免疫治疗
免疫疗法,尤其是ICI,改变了癌症治疗的方向,胃癌也不例外。胃癌包括具有中高肿瘤突变负荷(TMB)的肿瘤,一些亚型如MSI-H肿瘤或EBV相关癌症,对免疫治疗特别敏感。
一些抗PD-1药物已在一线环境中与标准化疗联合使用。在包括1581名患者的III期CheckMate-649试验中,Nivolumab联合化疗(奥沙利铂和氟嘧啶)优于单独化疗。实验组的中位总生存期为13.1个月,对照组为11.1个月(P<0.0001)。在KEYNOTE-062试验中,免疫化疗联合治疗的结果没有重复,这是一项采用相同方法进行的pembrolizumab的III期试验,在化疗中加入pembrolizumab与化疗相比没有任何益处。尽管存在争议,但在PD-L1 CPS≥10的人群中,pembrolizumab单药治疗优于化疗。KEYNOTE-590 III期试验主要集中于食管癌,但12%的患者肿瘤位于GOJ。这项研究表明,在所有患者中,在化疗中加入pembrolizumab对总生存率有益处,中位总生存期12.4个月vs 9.8个月(P<0.0001)。
总之,关于免疫疗法,每个试验中选择的化疗类型可能会影响结果的差异。ICI的治疗线也有所不同,关于ICI治疗的最佳治疗线仍不确定。考虑到相关试验的令人鼓舞的结果以及胃癌患者的脆弱性,一线治疗可能会带来更好的结果。
此外,最近的数据显示HER2和PD-L1阳性之间存在实质性重叠(85%),这支持抗HER2和抗PD-L1双重治疗。目前正在进行ICI和多重激酶抑制剂的联合检测,包括regorafenib和nivolumab或lenvatinib和pembrolizumab的组合。这些组合的基本原理仍然存在疑问,但可以基于ICI和靶向治疗之间可能的协同作用来解释。
在局部晚期的围手术期治疗中,免疫治疗也已取得初步结果。已经测试了不同的组合,包括camrelizumab(抗PD-1)加奥沙利铂和5-氟尿嘧啶-亚叶酸(FOLFOX6),toripalimab(抗PD-1)加FLOT,或avelumab(抗PD-L1)加多西紫杉醇-顺铂-5-氟尿酸的改良方案。在新辅助放化疗后的局部晚期疾病中,CheckMate-577研究是首次在GOJC患者中显示nivolumab辅助治疗阳性结果的III期试验。该研究包括食管癌患者(60%;鳞状细胞癌和腺癌)和GOJC患者(40%)。nivolumab组的无病生存率更好(22.4个月 vs 11.0个月;P<0.001)。
抗血管生成治疗
血管生成是癌症的特征之一,胃癌通常表达高水平的血管内皮生长因子(VEGF)并分泌促血管生成细胞因子。然而,抗血管生成治疗在胃癌的临床实践中的结果一直存在差异。
抗VEGFR2抗体Ramucirumab在二线治疗中,与安慰剂相比,显示出有限的单一治疗效果(REGARD试验);与单独化疗相比,Ramucirumab与紫杉醇的联合略微提高了总生存率(RAINBOW试验)。因此,Ramucirumab和紫杉醇的联合治疗成为新的治疗标准。目前,一项测试Ramucirumab和tusamitamab–ravtansine组合的研究将进一步评估这种有希望的疗效(NCT05071053)。
Apatinib是一种VEGFR2的小分子酪氨酸激酶抑制剂,在267名中国患者的临床试验中,与安慰剂相比,它提高了难治性人群的总体生存率。不幸的是,这些结果没有在国际试验中重现。尽管如此,Apatinib作为二线治疗的使用正在评估中。
尽管在二线及以上的治疗中有活性,但在一线治疗中靶向血管生成似乎与疗效无关。在未经选择的胃癌患者中,将Ramucirumab(RAINFALL试验)和抗VEGFA单克隆抗体bevacizumab(AVAGAST试验)加入一线化疗时,均未显示出足够的活性。
靶向治疗
在最初的靶向治疗中,一些靶点未能证明更好的疗效。例如EGFR,在5–10%的胃癌中检测到EGFR扩增或EGFR过表达,但使用单克隆抗体或TKIs在未选定人群中进行的大型III期试验失败。然而,在后期生物标志物分析或小型临床研究中,治疗EGFR扩增肿瘤的患者的结果要好得多,有效率为58%,PFS为10个月,表明在选定人群中有益处。
MET受体是肝细胞生长因子的酪氨酸激酶受体,两种针对此靶点的单克隆抗体,分别为onatuzumab和rilotumumab,在一线治疗中进行的两项大型随机III期试验(METGasteric试验和RILOMET-1试验)的结果显示,总体存活率没有改善。MET靶向策略仍然具有挑战性,必须仔细评估肿瘤异质性以及原发和获得性耐药。
同源重组修复缺陷使肿瘤对DNA损伤化疗和聚ADP核糖聚合酶抑制剂(PARPi)敏感。在全球7-12%的胃癌中发现了同源重组修复缺陷相关特征,高达3%的患者在同源重组修复相关基因如BRCA1、PALB2和RAD51C中出现了种系突变。然而,一项紫杉醇与olaparib的III期GOLD试验中,显示无明显益处。目前,正在评估其他PARPi和抗血管生成剂以及免疫治疗的组合。
已观察到胃癌患者中哺乳动物雷帕霉素(mTOR)靶点的失调,早期试验中报告了口服mTOR抑制剂everolimus的一些活性。III期GRANITE-1试验在656名未选择的胃癌患者中进行。然而,与安慰剂相比,everolimus并没有改善这些患者的总体生存率。
虽然,这些最初探索的靶向治疗未能取得很好的疗效,但目前出现一些新的,有前途的靶点,显示出良好的应用前景。FGFR2在全球高达15%的胃癌患者中扩增,并与更糟糕的预后相关,一些药物已经针对该受体进行了测试。例如bemarituzumab在随机II期FIGHT试验中进行了测试,该试验将标准化疗(FOLFOX6)与联合bemarituzumab进行了比较。该组合改善了FGFR2b过表达胃癌的PFS和总生存率。Derazantinib是一种口服的FGFR1、FGFR2和FGFR3 TKI,正在进行一项临床试验测试Derazantinib作为单一疗法或与紫杉醇、ramucirumab或atezolizumab联合治疗携带FGFR2基因畸变的HER2阴性胃癌患者的疗效。
Claudins(CLDNs)是维持细胞间紧密连接粘附的蛋白质,CLDN18.2存在于胃粘膜的分化上皮细胞中,在胃癌患者中高表达。zolbetuximab是一种靶向CLDN18.2的嵌合IgG1抗体,在随机II期FAST试验中,与一线化疗相比,在化疗中加入zolbetuximab提高了PFS和总生存率。此外,一些新的抗CLDN18.2药物正在评估中。例如,针对CLDN18.2特异性的CAR-T细胞正在进行的I期临床试验中报告了阳性结果,28例CLDN18.2阳性胃癌患者的有效率为57.1%。目前,其他临床试验正在进行中。
小结
胃癌是世界上第五大最常见的癌症,也是第四大癌症死亡原因,其明显的流行病学、组织学和分子差异加剧了这种复杂疾病的治疗难度。目前,HER2和PD-L1 CPS阳性胃癌肿瘤具有已建立的靶向治疗,其他新的组合方法也正在研究中。治疗策略侧重于不同RTK途径中存在干扰的肿瘤,如FGFR2扩增或CLDN18.2阳性胃癌。此外,更具包容性的大规模测序计划正在扩大胃癌患者肿瘤个性化治疗的前景。考虑到胃癌患者分子特性、空间和时间肿瘤异质性,整合每个胃癌患者的临床和分子数据,必将有助于制定最佳的个体化治疗策略,最终提高患者的总体生存率和生活质量。
参考文献:
1.Currentdevelopments in gastric cancer: from molecular profiling to treatment strategy.Nat Rev Gastroenterol Hepatol.2022 Nov 7.
原文标题:胃癌治疗的最新研究进展
-
比克电池林建分享尖晶石镍锰酸锂(LNMO)新型材料电池研究进展
2022-11-16 -
最新最全!中央任命,98家央企掌门人!
2022-11-15 -
靶向p53癌症治疗药物的研究进展
2022-11-01 -
最新!金刚玻璃决定10月10日起更名
2022-10-08 -
2022全球晶圆代工厂最新排名出炉:台积电第一、中芯国际第五
2022-09-29 -
阿尔茨海默病的免疫治疗研究进展
2022-09-28 -
大族激光第三代半导体设备最新动态
2022-09-27 -
大族激光新能源动力电池设备项目最新动态
2022-09-15 -
27地BIPV补贴:0.1-0.4元/千瓦时不等!BIPV最新资料包(26省市,77条)
2022-09-10 -
欧洲能源短缺问题最新进展
2022-07-20 -
全部驳回!国产基带龙头翱捷科技公布诉讼事项最新进展
2022-07-01 -
最新最全!全国74项抽水蓄能政策【汇整版】出炉!(文末下载)
2022-07-01 -
光谱学技术获最新突破,利用阿秒激光爆发作为泵浦和探测脉冲
2022-06-14 -
武汉光电国家研究中心国伟华教授团队报道4项新型光电子器件重要研究进展
2022-06-01 -
166电池涨2分、182电池涨1分!通威最新电池报价
2022-05-31